クリングルファーマ、米国子会社Kringle Pharma USAを起点にIND準備を加速 脊髄損傷急性期で海外市場へリーチ
アジェンダ

安達喜一氏:みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長の安達喜一です。本日は、2026年9月期第1四半期の決算についてご説明します。
スライドは、本日のアジェンダです。はじめに会社概要として、当社の特徴、ビジネスモデル、成長戦略についてお話しします。続いて、開発パイプラインの進捗状況として、2026年9月期第1四半期のトピックス、第1パイプラインの脊髄損傷急性期、第2パイプラインの声帯瘢痕についてお話しします。最後に、2026年9月期第1四半期の決算概況として、経営成績ならびに財政状態についてご説明します。
会社概要

会社概要です。当社は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」を企業理念とする大学発の創薬バイオベンチャーです。
現在、日本で発見された体内に存在するタンパク質であるHGFの医薬品開発に注力しています。HGFは、スライド左側の図にあるように692個のアミノ酸が数珠状につながり、19個の分子内架橋によって非常に複雑な三次元構造を形成しています。上部にクローバーのような形がありますが、これはクリングル構造というタンパク質のモチーフであり、当社の社名の由来にもなっています。
HGFは、もともと肝臓の細胞を増殖させるタンパク質として発見され、肝臓の再生を担う重要な役割を持つタンパク質とされています。しかし、その後の研究により、肝臓だけでなく、さまざまな組織や臓器において「再生」「修復」の役割を担う、非常に重要なタンパク質であることが明らかになりました。さらに、HGFは単に細胞を増殖させるだけでなく、細胞を「保護」する働きや線維化を抑制する働き、血管新生や軸索再生など、幅広い生物学的機能を持つこともわかっています。
なお、このHGFは「Oremepermin Alfa(オレメペルミン アルファ)」という国際一般名称がすでに決定しています。
HGF再生治療薬のプラットフォーマー:HGFタンパク質の量産体制
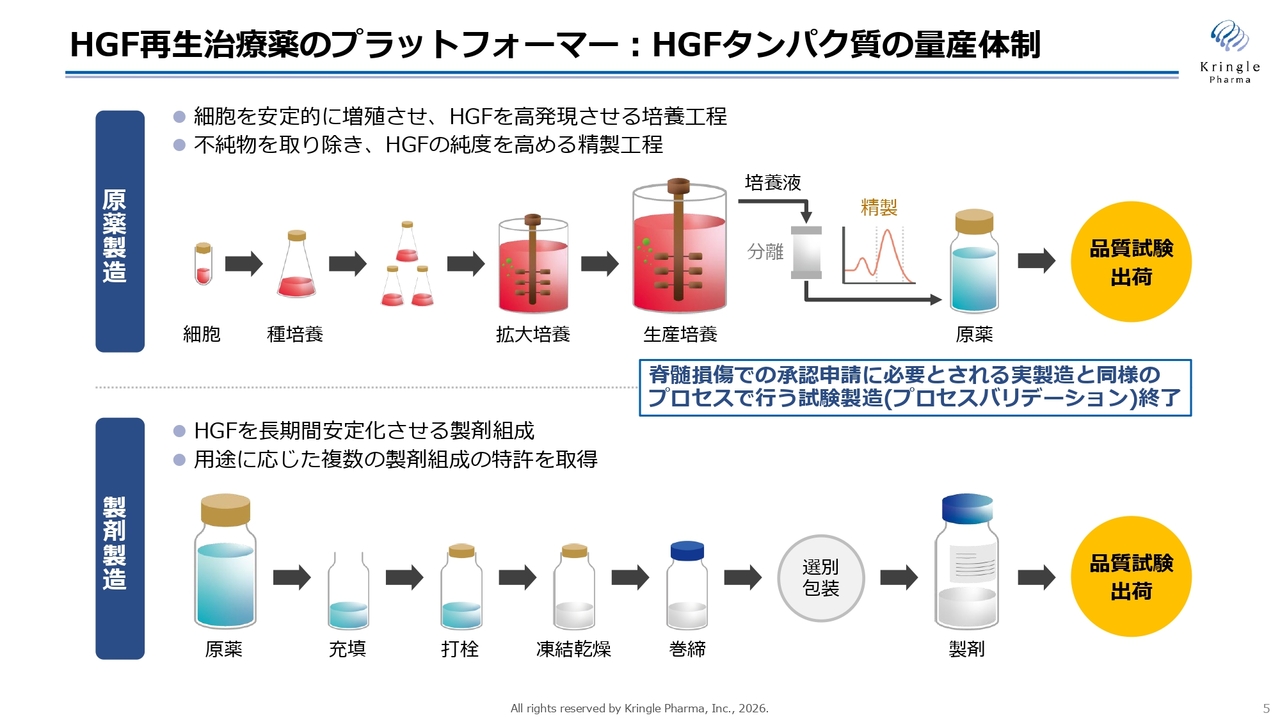
当社の強みです。当社は、複雑なHGFというタンパク質を、医薬品グレードで確実に製造する体制をすでに整えています。医薬品グレードのHGFを用いて複数の臨床試験を実施し、さらに第Ⅲ相試験、レイトステージまでパイプラインが進捗しています。
スライドには、HGFタンパク質の製造方法を非常に簡略化して記載しています。実際には非常に複雑な工程であり、その製造方法に関するノウハウはすべて秘匿しています。
HGFは化学合成では製造できないため、細胞にヒトのHGF遺伝子を挿入し、その細胞を大量に培養して原薬を製造します。そして、その原薬をガラスバイアルに充填し、凍結乾燥することで、最終製品となる製剤が完成します。
なお当社は、脊髄損傷における承認申請に必要とされる、実製造と同様のプロセスで実施する試験製造(プロセスバリデーション)もすでに終了しており、承認後の商業製造の体制も整えています。
HGF再生治療薬のプラットフォーマー:希少疾病を対象とする戦略
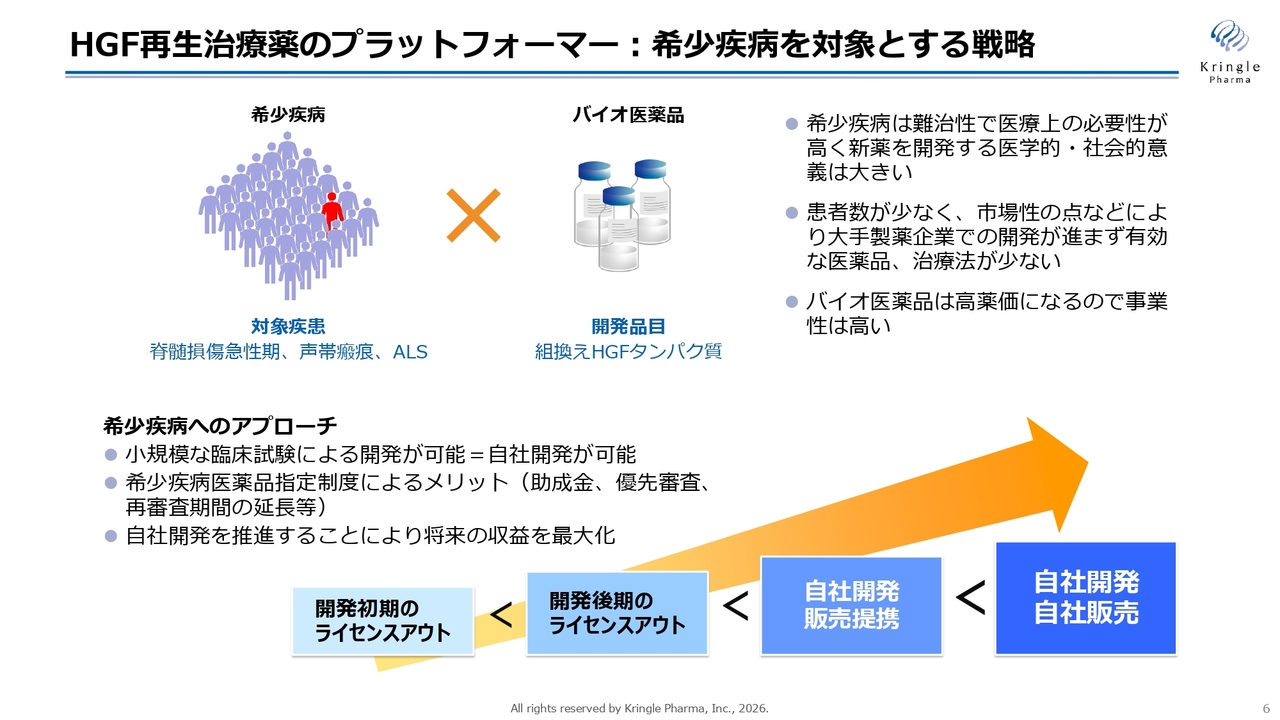
スライドは、当社のビジネスモデルです。当社は希少疾患を対象に、組換えヒトHGFタンパク質、いわゆるバイオ医薬品を開発しています。
当社は、現在国内で進めているレイトステージの脊髄損傷急性期および声帯瘢痕について、製薬企業にライセンスアウトするのではなく、承認を取得するまで自社で開発を完遂する方針で進めています。これは、多くのバイオベンチャーと異なる点です。
当社は、最終的に製薬企業に成長することを目指しています。そのため、最終的には自社開発・自社販売が可能になる体制を構築していきたいと考えていますが、現時点では販売体制が整っていないため、販売に関しては製薬企業と提携しています。一方、国内の開発については自社で責任をもって完遂し、承認を取得して自社で製品を保有することに重点を置いています。
開発パイプラインの概要
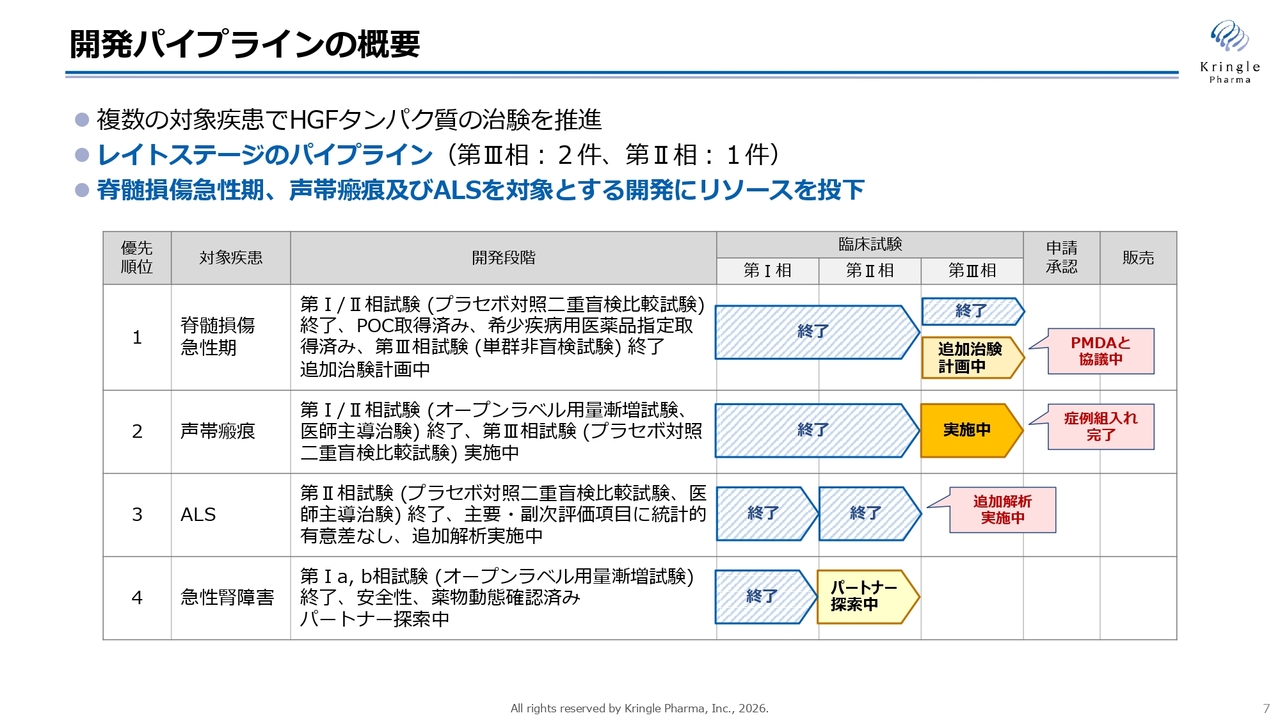
スライドは、臨床段階にある開発パイプラインとして、4つのパイプラインを示しています。第1パイプラインの脊髄損傷急性期は、国内で第Ⅰ/Ⅱ相試験および第Ⅲ相試験の2本がすでに終了しています。第Ⅲ相試験終了をもって承認申請に進む計画でしたが、PMDAとの協議の結果、追加治験が必要であることが判明しました。現在は、PMDAと協議を進めながら、追加治験を準備しているところです。
第2パイプラインの声帯瘢痕は、国内で第Ⅰ/Ⅱ相試験が終了し、現在は第Ⅲ相試験を実施中です。詳細は後ほどお話ししますが、ようやく症例組入れが完了し、試験の終了およびデータのリードアウトが見えてきました。
第3パイプラインの筋萎縮性側索硬化症(ALS)については、国内で第Ⅰ相試験と第Ⅱ相試験の2つの試験が終了し、現在はバイオマーカーの追加解析を引き続き実施しています。
第4パイプラインの急性腎障害については、米国で第Ⅰ相試験が終了し、現在は第Ⅱ相試験に進むためのパートナーを探索中です。
クリングルファーマの成長戦略
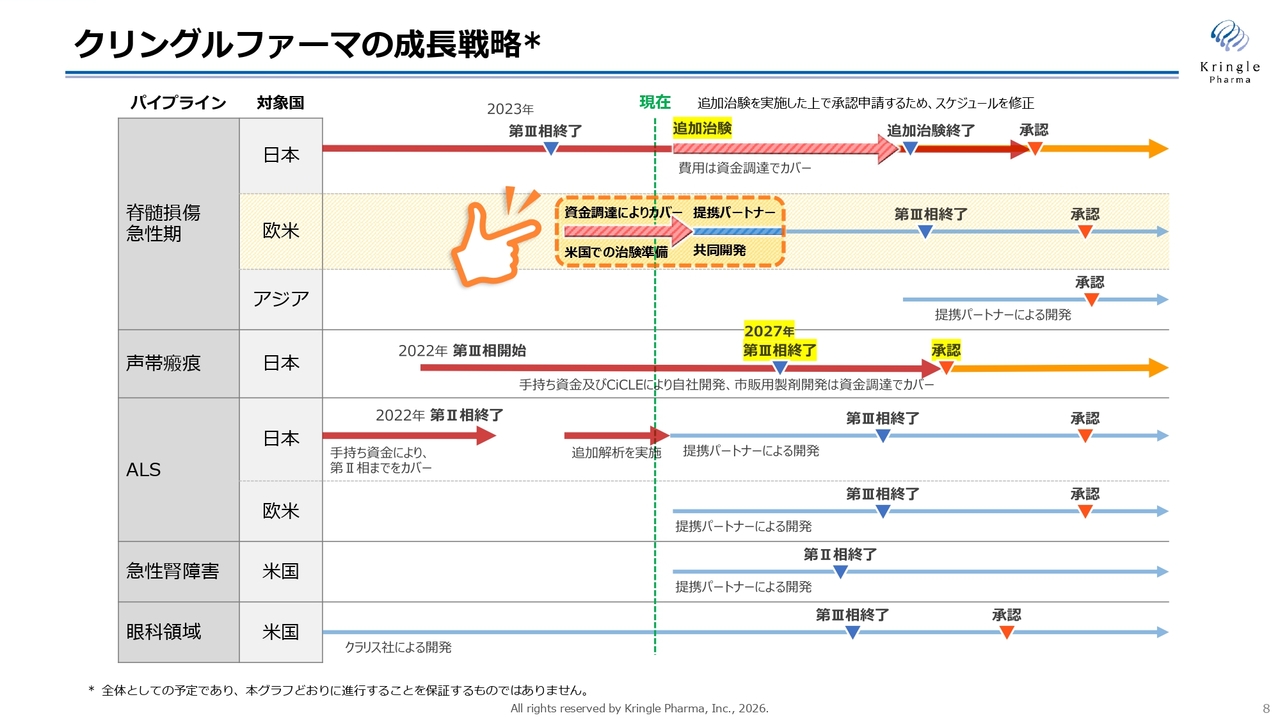
スライドは、前回の通期決算説明会でもお示しした成長戦略です。
脊髄損傷急性期について、国内では追加治験を実施し、承認申請および承認取得を目指しています。現在、追加治験のための費用を調達するべく資金調達を行っています。後ほどお話ししますが、米国および欧米での開発にも並行して着手しています。特に米国では治験を開始し、承認を取得することで、いち早く海外市場にアクセスすることを目指しており、現在この分野に力を注いでいます。
声帯瘢痕については、第Ⅲ相試験の症例組入れが終了しました。2027年に第Ⅲ相試験を終了し、これをもって承認申請に向かう方針です。
クリングルファーマの成長戦略:3本の矢
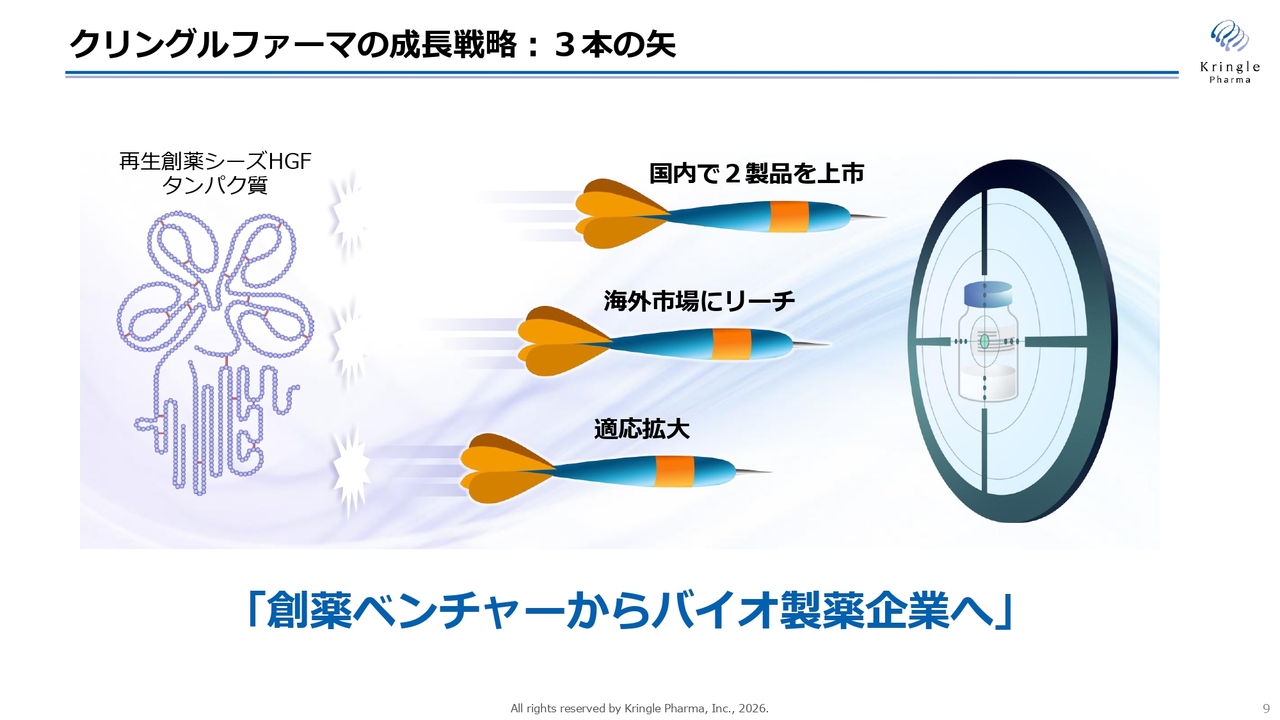
スライドには、当社の成長戦略を簡単にお示ししています。「3本の矢」を着実に的確に当てることで、「創薬ベンチャーからバイオ製薬企業へ」と成長していくことを目指しています。「3本の矢」とは、1本目が国内での2製品の上市、2本目が海外市場へのリーチ、そして3本目が適応拡大を指します。これを着実に実行することで、企業価値の向上を目指していきます。
成長戦略1:国内で2製品を上市する
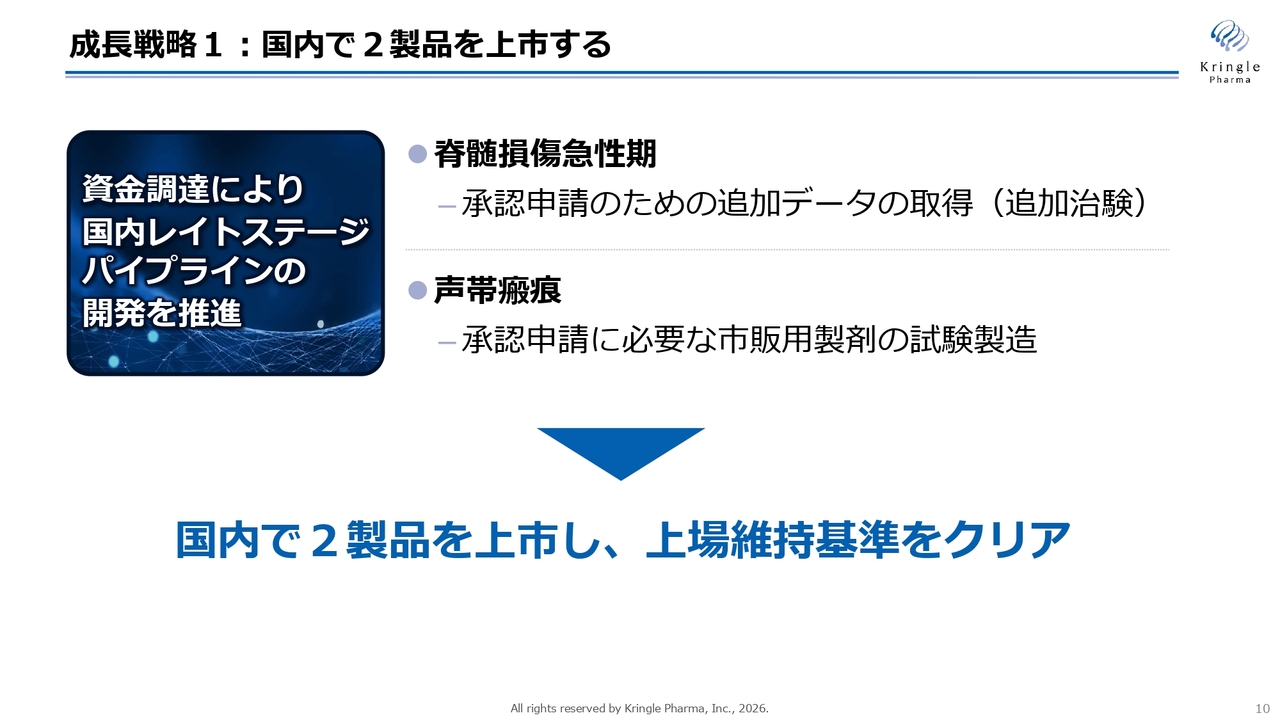
まず、1本目の矢についてです。国内で2製品を上市するという目標に向けて、現在国内で第Ⅲ相試験の段階にある2つのパイプライン、すなわち脊髄損傷急性期と声帯瘢痕について、着実に開発を進め、承認を取得することが非常に重要な成長戦略となります。
先ほどご説明したとおり、脊髄損傷急性期については追加治験を行うため、PMDAとの協議を進めています。一方、声帯瘢痕については、第Ⅲ相試験の終了が見えてきましたので、承認申請に必要な市販用製剤の試験製造にも着手しています。
国内でこの2製品を上市することで、企業価値を向上させるとともに、東証グロース市場の上場維持基準をきちんとクリアすることを目指しています。
成長戦略2:海外市場にリーチする
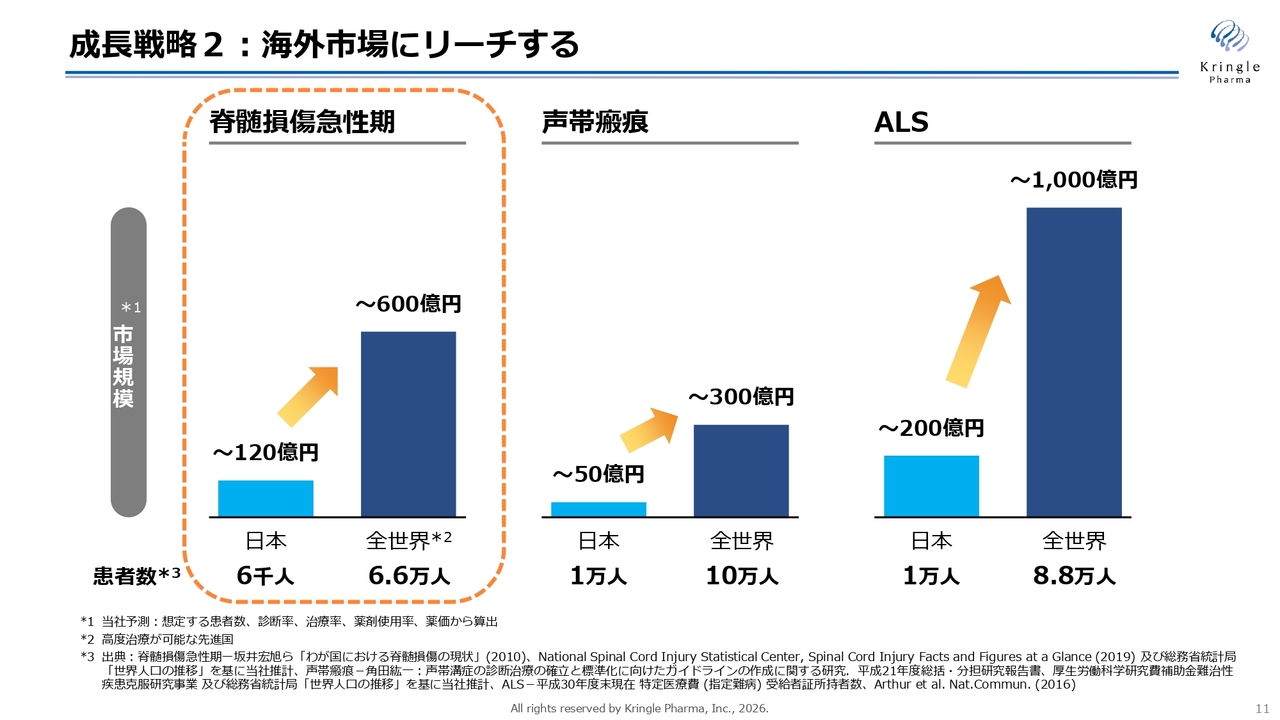
2本目の矢は、海外市場への早期リーチです。スライドでは、いずれも希少疾患である脊髄損傷急性期、声帯瘢痕、ALSの国内における患者数および想定される市場規模を、グローバル市場と比較して示しています。
当然のことながら、日本国内だけで考えると市場は限定的です。一方、世界を見渡すと、日本の10倍ほどの患者数がいる状況です。そのため、早期に国際市場へアクセスすることが、当社の成長において非常に重要なポイントとなります。
現在は、スライドのオレンジ色の点線で囲んでいる脊髄損傷急性期の海外展開に、特に力を入れているところです。
海外開発戦略
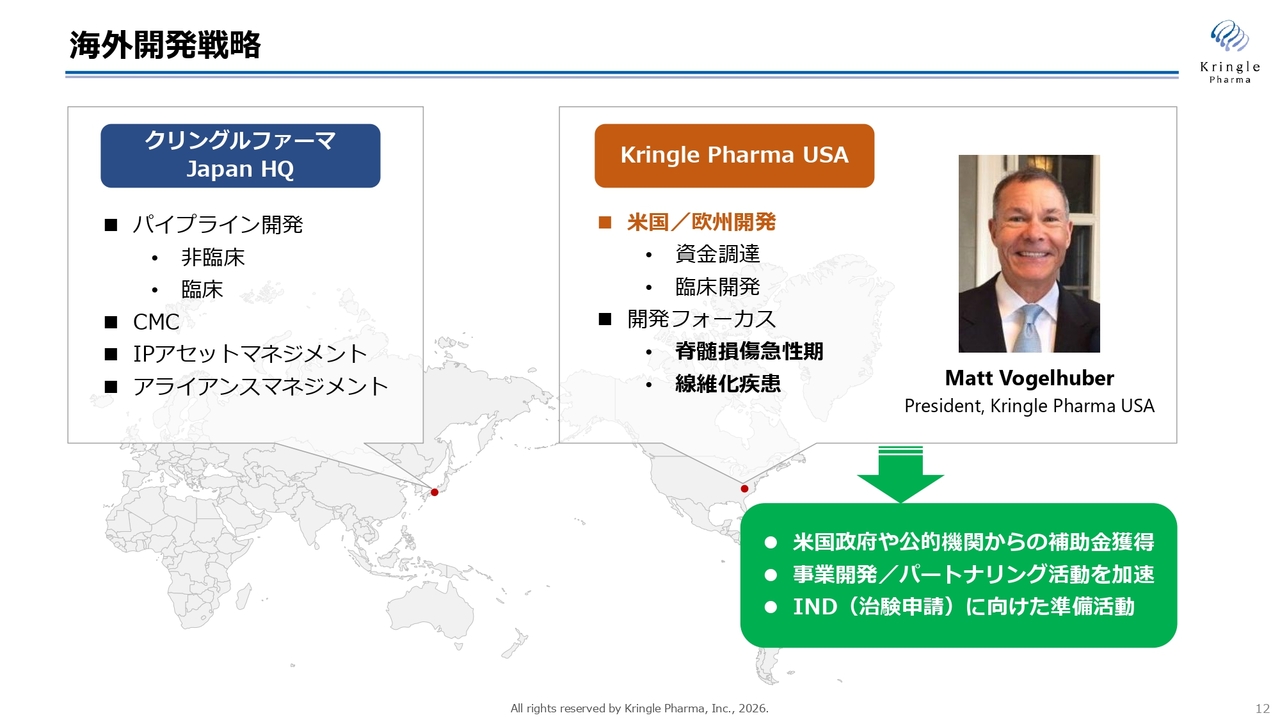
当第1四半期の大きなトピックスとして、米国にKringle Pharma USAという100パーセント子会社を設立しました。この子会社を起点に、米国や欧州での開発を推進していきます。
具体的には、資金調達や臨床開発を計画しています。また、開発の重点分野は、国内で進行中の脊髄損傷急性期および声帯瘢痕になります。声帯瘢痕は線維化疾患の一種ですが、声帯瘢痕を含めた線維化疾患全般をターゲットにしていきたいと考えています。
Kringle Pharma USAのPresidentには、Matt Vogelhuber氏が着任しています。彼は長年製薬業界に従事しており、Eli LillyおよびEli Lilly Japanに駐在していた経験もあります。彼を中心に、現在米国での活動に力を入れています。当面は米国政府や公的機関からの補助金獲得を目指し、事業開発やパートナーリング活動をさらに加速させます。また、米国での治験申請(IND)に向けた準備活動にも力を注いでいます。
成長戦略3:適応拡大する
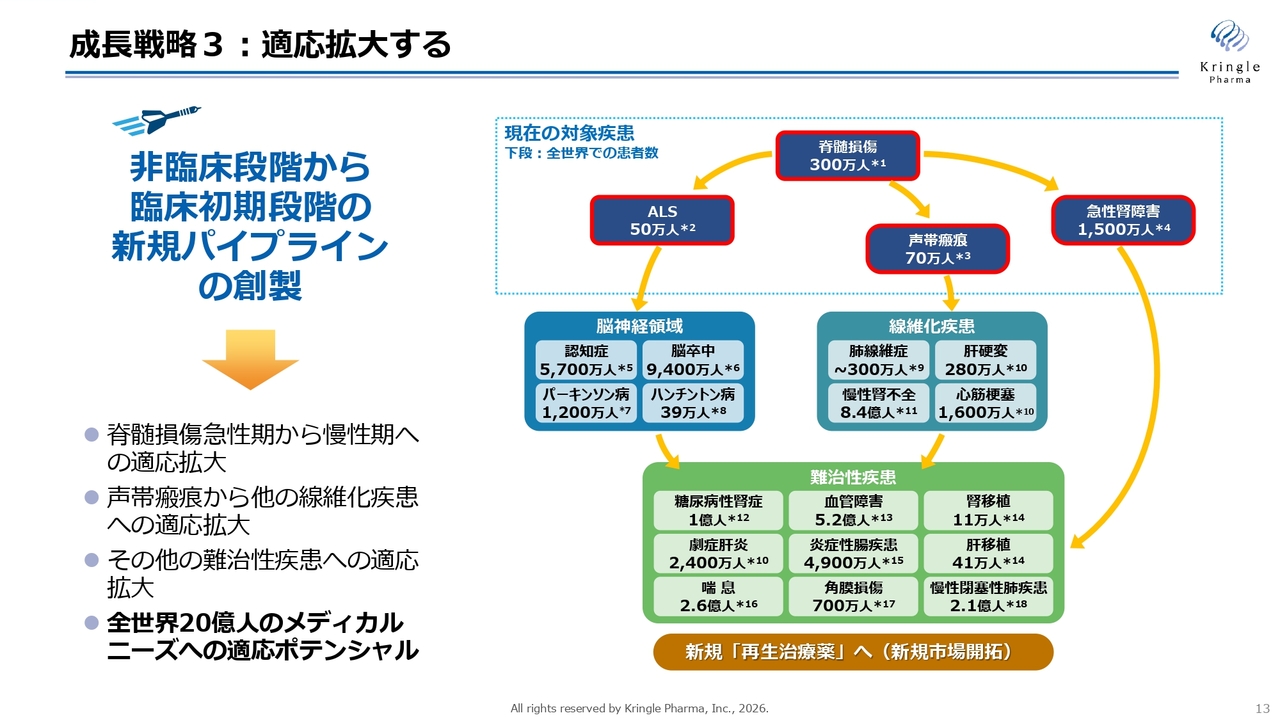
3本目の矢は、適応拡大です。冒頭で述べたように、HGFは肝臓だけでなく、さまざまな組織や臓器の再生、修復に関わっています。多くの論文が発表されており、動物モデルでさまざまな疾患に効果があることが示されています。
スライド右側の図は、論文として発表されている疾患を列挙したものです。当社が開発を進めている脊髄損傷、ALSに加え、脳神経領域への拡大、声帯瘢痕を起点とした非常に大きな線維化疾患の市場、さらにはその他の難治性疾患にも順次適応を拡大していきます。
スライドには、全世界での患者数を示していますが、これをすべて合計すると約20億人になります。HGFを医薬品として活用し、日本だけでなく世界へ発信することで、非常に大きな医薬品としての適応可能性があることを示しています。そのため、適応拡大を速やかかつ効率的に進めることで、HGFの価値を最大化し、当社の企業価値を飛躍的に向上させることにつながると考えています。
2026年9月期第1四半期の主なニュースリリース(後発事象を含む)

続いて、開発パイプラインの進捗状況についてご説明します。スライドは、当第1四半期における後発事象を含めた主なニュースリリースをお示ししています。昨年10月には、京都大学と新たな共同研究を開始しました。この研究は、HGFを用いた徐放性創傷治療剤の開発に関するものであり、HGFの新たな適応拡大につながるプロジェクトです。
また、昨年11月には、米国に子会社Kringle Pharma USAを設立しました。同じく11月には、慶應義塾大学との共同研究の成果として、脊髄損傷の自然回復を予測する新たなバイオマーカーに関する論文が掲載されました。さらに、声帯瘢痕を対象とした第Ⅲ相試験で、組入れが目標症例数に到達し、今年1月には最終症例の組入れを完了しました。
昨年12月には、リプロセル社との契約を更新しました。これは、HGFの研究用試薬の供給に関する契約です。これまでも当社が製造した研究用グレードのHGFをリプロセル社に供給していましたが、この契約を更新することで、リプロセル社を通じて、当社製造のHGFを試薬として購入できます。
同じく12月には、脊髄損傷急性期について欧州で希少疾病用医薬品指定(オーファン指定)の申請を行いました。脊髄損傷急性期については、すでに日本、米国でオーファン指定を取得済みですが、これに続き、今回欧州でも申請を行いました。欧州でもオーファン指定を取得することで、当社の脊髄損傷急性期治療のグローバルでの価値が非常に高まると考えています。順調に進めば、今年の前半には指定が取得できる見込みであり、その際には適時に開示します。
さらに12月に、HGFを用いた精神性疾患に対する新規治療剤に関して特許出願を行いました。これは、京都府立医科大学との共同研究の成果です。声帯瘢痕だけでなく、さまざまな線維性疾患にも応用可能な新たな治療剤に関する特許出願となります。
また、本日午前中に、当社の提携先であるクラリス・バイオセラピューティクス(以下、クラリス社)による資金調達に関するニュースリリースを開示しました。
クラリス社による眼科領域でのHGFタンパク質の開発
クラリス社での開発については、これまでもスライドなどでお示ししてきましたが、あらためて過去の経緯も含めてご説明します。
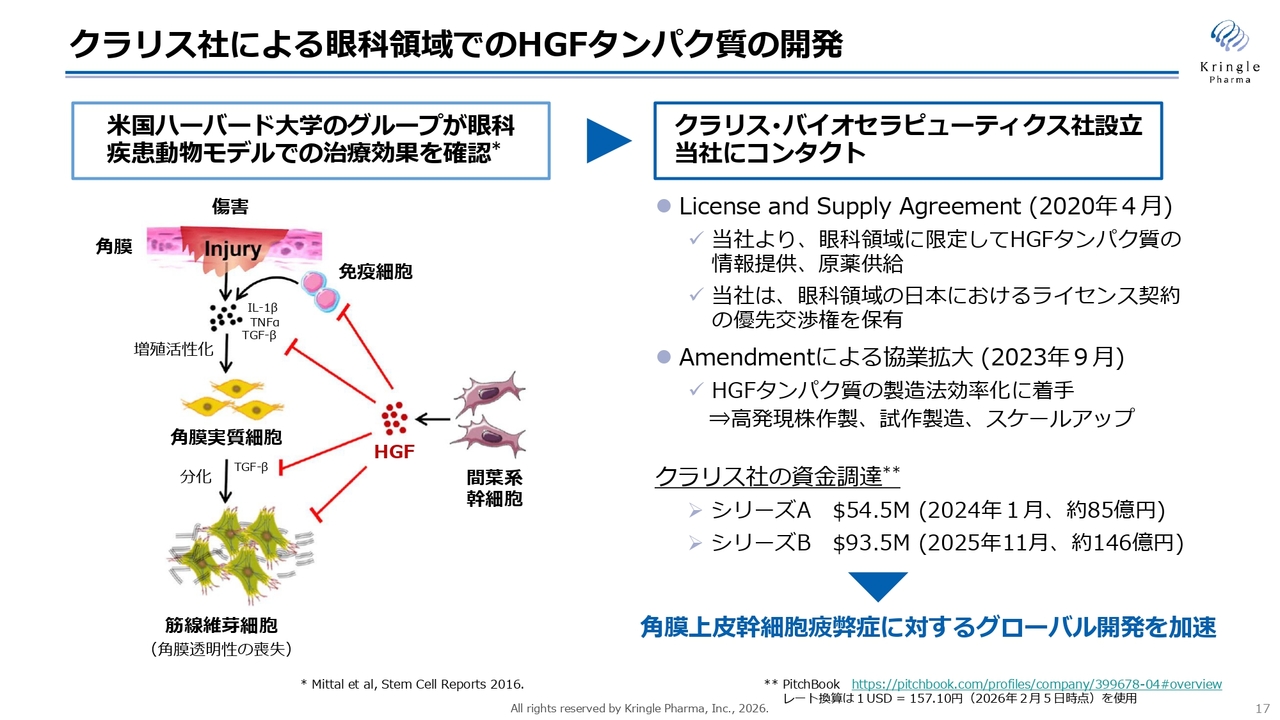
もともと、米国ハーバード大学の眼科に在籍しているDr. Reza Danaが、角膜損傷の動物モデルに間葉系幹細胞を移植する研究を行っていました。間葉系幹細胞を角膜損傷モデルに移植すると効果があることが判明し、この間葉系幹細胞のタンパク質発現プロファイルを詳細に調べたところ、HGFタンパク質を多く発現していることがわかりました。
そこで、HGFタンパク質を投与しても効果があるのではないかと考え試験を行ったところ、HGFタンパク質を投与するだけでも十分に効果があることが確認でき、2016年に論文として発表されました。スライド左側の図は、その論文に掲載されていた図を日本語に訳したものです。
角膜損傷モデルでは、免疫細胞が侵入すると炎症性サイトカインが産出され、それにより角膜の実質細胞が増殖します。その後、TGF-βの働きによって実質細胞が分化し、筋線維芽細胞となることで増殖が進み、角膜の透明性が失われ、眼が濁る原因となります。これに対して、HGFがさまざまな側面で抑制効果を発揮することがわかりました。
Dr. Reza Danaのグループは、クラリス社というバイオベンチャーを創業し、このHGFタンパク質を眼科領域で開発することに着手しました。当社の強みでもあるように、当社はHGFタンパク質を医薬品グレードで製造できる世界でも唯一の企業です。そのため、当社にコンタクトがあったことがそもそものきっかけです。
その後、当社と交渉を重ね、2020年4月にLicense and Supply Agreementを締結しました。当社からは、眼科領域に限定してHGFタンパク質に関する情報を提供するとともに、タンパク質の原薬の供給を開始しています。
当社のHGFタンパク質は、医薬品グレードであるだけでなく、HGFタンパク質を用いて複数の臨床試験を実施しています。そのため、人における安全性についてのデータや有効性に関するデータが多数蓄積されています。これにより、単に物質を提供するだけでなく、付随するさまざまな非臨床試験・臨床試験の情報を活用することで、非常に効率的に開発を進められることが、当社と協業する最大のメリットです。
実際に、クラリス社は2020年4月に当社と契約を結び、その後わずか1年で米国でINDを行い、治験を開始しました。このことから、当社が蓄積している情報の価値の大きさをご理解いただけると思います。
なお、2020年4月の契約において、当社は眼科領域における日本でのライセンス契約の優先交渉権を保持しています。現在、クラリス社は眼科領域で開発を進めており、それについて日本でライセンス契約を締結することで、今後当社が日本において眼科領域での開発を開始する可能性もあります。
さらに、2023年9月にはこの契約を改訂し、協業範囲を拡大しました。これも非常に重要なポイントです。具体的には、HGFタンパク質は製造が非常に難しいタンパク質であるため、製造法の効率化に着手しました。
これは、今後の適応拡大やグローバル展開を考えると、HGFタンパク質をより多く製造する必要が生じるためです。現在使用している細胞株では限界があることから、新たな高発現の細胞株を作成し、それを用いて医薬品グレードのHGFを製造していく必要があります。具体的には、すでに高発現の細胞株を作成し、試作製造やスケールアップ作業を順調に進めています。
クラリス社はまだ上場していませんが、これまでに2回、大規模な資金調達に成功しています。シリーズAで5,450万ドル、シリーズBで9,350万ドルを調達しており、日本円に換算すると合計で200億円以上の資金を確保して開発を進めています。
クラリス社は、今後の方針として、角膜疾患である角膜上皮幹細胞疲弊症を第1パイプラインと位置づけ、このグローバル開発を加速する計画を掲げています。
クラリス社は、眼科領域に特化してHGFタンパク質を開発している会社ですが、このように2度にわたる大型資金調達に成功していることから、HGFのポテンシャルが海外の投資家に適切に理解され、高く評価されていると考えられます。
眼科領域だけでもこれだけの評価を得ているという点を踏まえると、眼科以外の分野、つまり当社が開発を進めている品目や適応拡大の可能性を考えた際に、非常に大きな価値があると思います。それをいかに効率的かつ効果的に開発していくかが、今後の当社の課題になると考えています。
開発パイプライン-脊髄損傷急性期-

当社の既存のパイプラインの状況についてお話しします。まず、脊髄損傷急性期についてです。脊髄損傷は、国内で毎年約6,000人が新たに罹患している状況です。特に急性期においては、薬剤や手術による根本的な治療法が存在しないことが現状です。ステロイドを大量に投与する方法は薬事上認められていますが、副作用が大きく、現場の医師が使用しづらいという課題があり、実質的に有効な薬がない状態です。
脊髄損傷は、患者さまのからだが動かなくなることで不自由を強いられるだけでなく、介護者にとっても非常に大きな負担となる疾患です。患者さまが少しでも動けるような薬を作ることで、非常に大きな医療経済効果が見込める疾患です。
脊髄損傷急性期にHGFに期待する治療効果
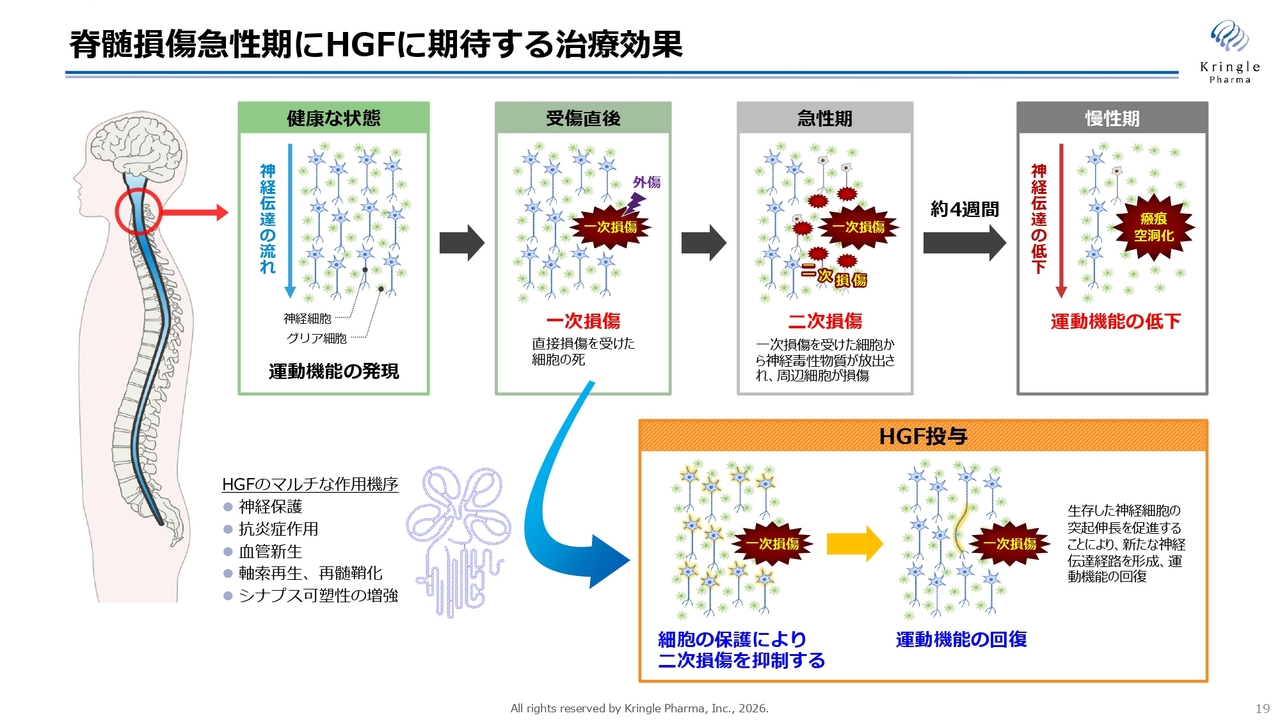
振り返りになりますが、HGFがなぜ脊髄損傷急性期に効果があるのかについてご説明します。脊髄損傷急性期では、一次損傷、すなわち最初に発生する損傷から、二次損傷という損傷が次々に広がっていく現象が起こります。最終的に慢性期になると、損傷範囲が瘢痕化して空洞化し、元に戻らなくなります。この影響で神経伝達が上から下に通らず、運動機能が低下することになります。
HGFには多面的な作用があります。神経保護、抗炎症作用、血管新生、軸索再生など、これらの多面的な作用が相まって、二次損傷の拡大を抑えることが動物モデルでも確認されています。二次損傷を抑えることができれば損傷範囲を小さくできるため、患者さまの予後や運動機能の回復が期待できると考えられます。
脊髄損傷急性期 第Ⅲ相試験 -重症度の改善、第Ⅰ/Ⅱ相との比較-
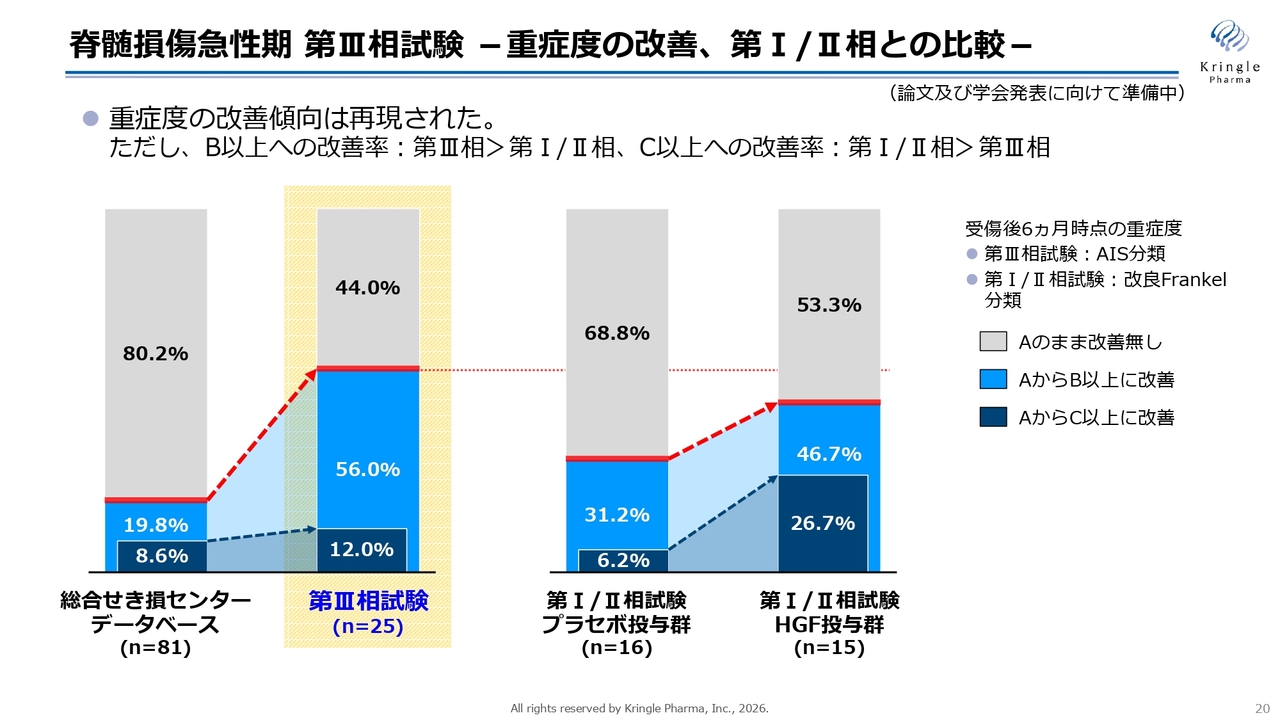
当社はすでに、国内でプラセボ対照二重盲検比較試験である第Ⅰ/Ⅱ相試験を終了しており、患者さまのヒストリカルなデータベースと比較する第Ⅲ相試験も終了しています。
スライドの棒グラフでは、重症度の改善状況を色分けでお示ししています。黄色い背景部分が第Ⅲ相試験における重症度の改善を対象としたデータです。いずれの試験も、重症度Aに該当する非常に重度の患者さまのデータとなっています。
重症度Aとは完全麻痺の状態を指し、運動機能や感覚機能が完全に失われている状態です。特にこの試験では頚髄損傷、すなわち首の損傷を有する患者さまを対象としており、首から下がまったく動かないという非常にシビアな状態の患者さまをリクルートしています。
このようなシビアな患者さまについて、スライド一番左側の総合せき損センターのデータベースの数字をご覧いただくと、グレー色で示した約80パーセントの方は重症度Aのままで改善が見られません。わずか約20パーセントの方が1段階以上重症度が改善するといったヒストリカルなデータベースの結果となっています。
これに対し、第Ⅲ相試験では、半数以上の方が1段階以上重症度が改善しています。濃い青色で示した2段階以上改善している割合については、データベースと比較して増加しているものの、統計的な有意差は確認されませんでした。ただし、1段階以上改善した割合については統計的に有意な差が認められました。
これを前相の第Ⅰ/Ⅱ相試験と比較したものが、スライド右側の棒グラフです。前相のプラセボ群とHGF投与群を比較した結果、HGFを投与することで重症度の改善が明確に増加していることが示されています。
特に第Ⅰ/Ⅱ相試験では、2段階改善する濃い青色の部分で一番大きな差が見られました。具体的には、プラセボ群では6.2パーセントに対して実薬群では26.7パーセントと、4倍以上の増加があったため、第Ⅲ相試験ではここを主要評価項目としました。
第Ⅰ/Ⅱ相試験と第Ⅲ相試験が終了後、さまざまな角度で分析を行いました。その結果、どちらの試験でも重症度の改善傾向は再現されているものの、1段階以上改善した割合と2段階以上改善した割合には、2つの試験で傾向の違いが見られることがわかりました。
脊髄損傷急性期 第Ⅲ相試験 -患者背景に関する考察-

スライドは、こちらに関する考察を記載しています。第Ⅰ/Ⅱ相試験では、高齢者の転倒や転落による脊髄損傷が多く見られ、その中でも中心性頚髄損傷と呼ばれるケースが多数ありました。これらの患者さまでは、下肢が回復しやすく、重症度分類でCまで改善する症例や、motor scoreで10点以上改善する症例が非常に多かったことが特徴です。
一方、第Ⅲ相試験は新型コロナウイルス感染症の流行下という厳しい状況で実施されました。特に高齢者が行動制限を徹底したことで、主に壮年層の交通事故などによる高エネルギー外傷の患者さまが多く、より重度な症例が組み入れられました。
その結果、重症度で1段階改善する症例や、motor scoreで5点以上改善する症例は多く見られたものの、重症度がCまでの2段階改善や、motor scoreが10点以上改善する症例は見られなかったのではないかと当社では考察しました。
これについては、すべてのデータをPMDAと共有し協議した結果、追加の臨床試験を実施し、有効性データを再取得することになりました。
脊髄損傷急性期 追加治験のコンセプト
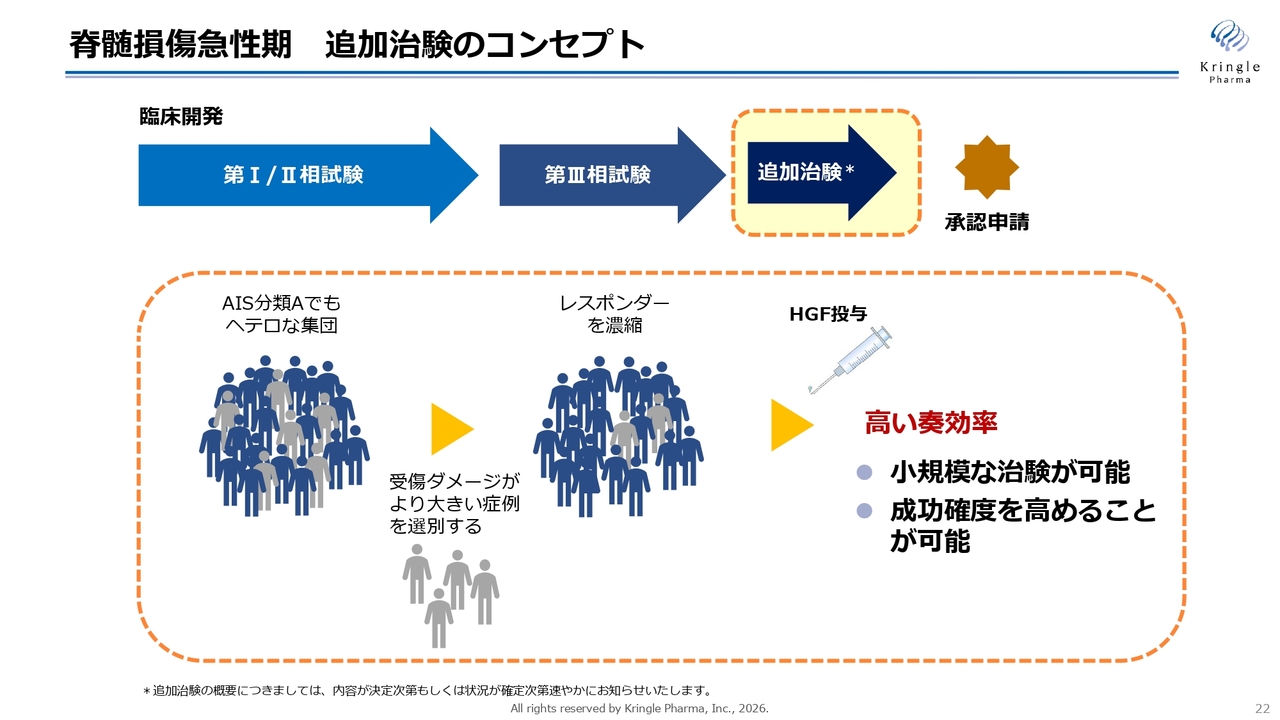
追加治験については、基本的なコンセプトをPMDAとすでに合意しています。重症度分類Aは完全麻痺の重度な患者さまが該当しますが、その中でもヘテロな集団で構成されています。重症度Aの中には、より重度な患者さまと、比較的重症度Bに近い症例の方が混在しています。
今回終了した第Ⅲ相試験の結論を踏まえ、重症度Aの中でもより重度なダメージが大きい症例を何らかの基準により除外することで、HGFの効果が見えやすい患者さまを絞り込み、濃縮する手法を採用します。これにより、高い奏効率を目指すことを基本的な考え方としています。
この方法によって、小規模な臨床試験をデザインすることが可能になり、成功確度も高まると考えています。
現在PMDAと協議しているポイントは「どういう条件で患者さまを選ぶか?」に関するものです。この件については方向性がほぼ見えてきていますが、PMDAと正式に合意し、治験のデザインが確定した段階で、みなさまにもご報告できると思います。
脊髄損傷急性期 薬事承認後のサプライチェーン
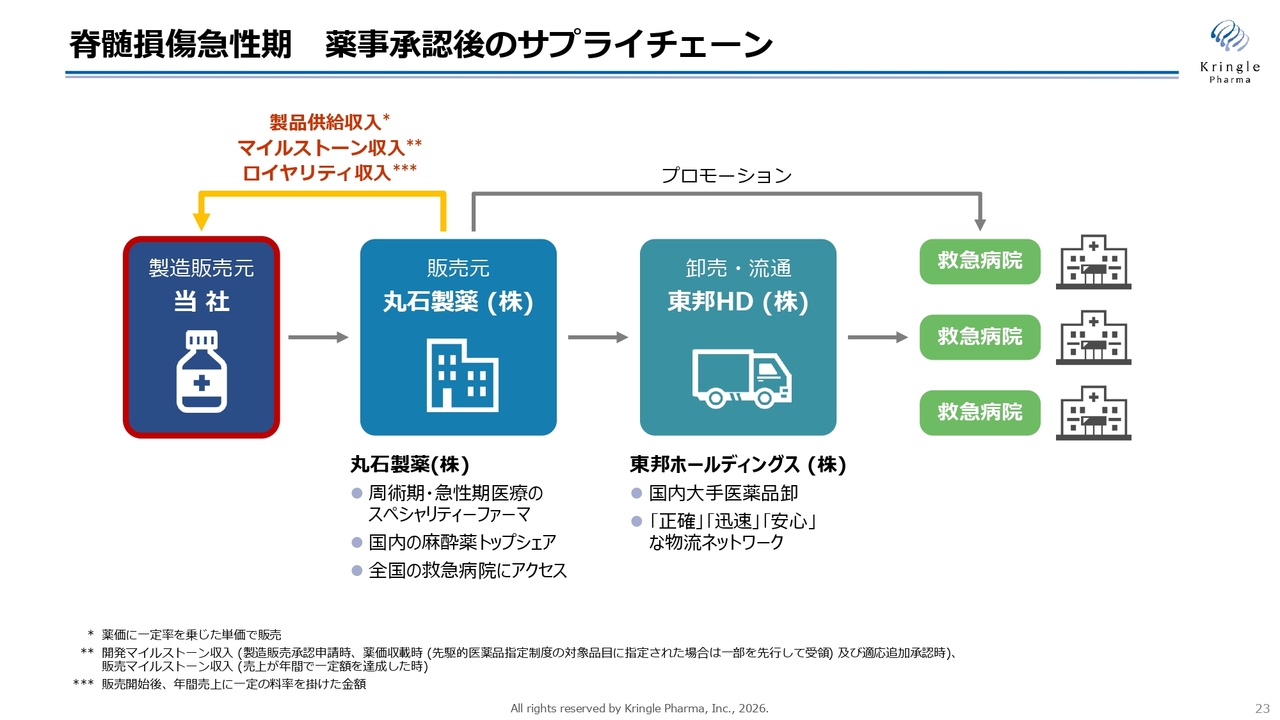
当社は追加治験を行い承認申請を取得しますが、承認後のサプライチェーンについては従前と変わりありません。当社が製造販売元となり、丸石製薬に製品を供給します。
丸石製薬は周術期・急性期医療のスペシャリティファーマであり、販売元となります。そして、医薬品の卸売には東邦ホールディングスを活用し、全国の救急病院に薬を供給する一手販売・一手卸の流通サプライチェーン体制がすでに確定しています。
開発パイプライン-声帯瘢痕-

続いて、第2パイプラインの声帯瘢痕についてです。これは線維化疾患の一種であり、希少疾患に分類されます。声を出すための声帯は、非常に高速で振動し声を生み出しています。この声帯がなんらかの原因で線維化し硬くなると、正常に振動できなくなり、結果として声が出にくくなり、重症になると声が出なくなる疾患です。
日本国内の患者数は約1万人とされており、有効な治療薬や治療法がまったくないため、アンメット・ニーズの高い疾患となっています。
発声障害の患者さんの声

スライドは、患者さまの団体であるSDCP発声障害患者会のリーフレットから転載したものです。声が出るというのは私たちにとって当たり前のことですが、それが出なくなるというのは本当に大変なことで、少しでも声が出にくくなるだけで、どれほど生活の質(QOL)が損なわれるかが、患者さまの声として記載されています。
また、声が出にくいという状態だけで、自分の意見が言いづらくなり、職場や学校で疎外されているような状況に追い込まれることがあります。そのため、私たちが想像している以上にQOLを大きく損なう疾患であることが、リーフレットから明らかになっています。
声帯瘢痕に対するHGFの作用機序
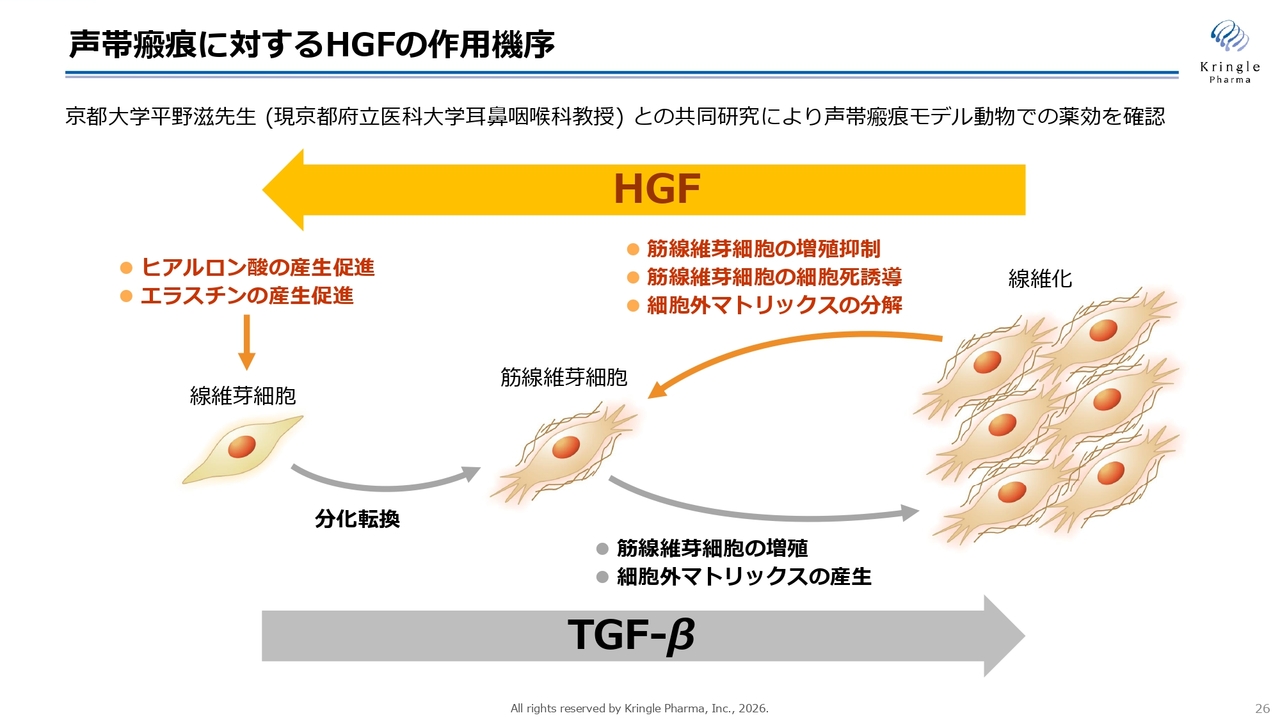
スライドは、HGFの作用機序を示しています。当社は、京都府立医科大学の平野滋先生と長年にわたり共同研究を行っています。
いわゆる線維化とは、線維芽細胞が筋線維芽細胞に分化し、それが増殖することでコラーゲンなどの硬い物質を産生し、これが線維化につながる過程を指します。この現象にはTGF-βという細胞内のタンパク質が関与していることがよく知られていますが、HGFはこれを逆方向に進める働きを持っています。
HGFはコラーゲンを分解する酵素を多く作らせたり、筋線維芽細胞の細胞死を誘導して増殖を抑制する働きがあります。一方で、ヒアルロン酸やエラスチンといった細胞を柔らかく維持する物質の産生を促進します。これらの作用により、HGFの多岐にわたる働きが抗線維化へとつながることがすでに明らかになっています。
声帯瘢痕 第Ⅰ/Ⅱ相試験の結果
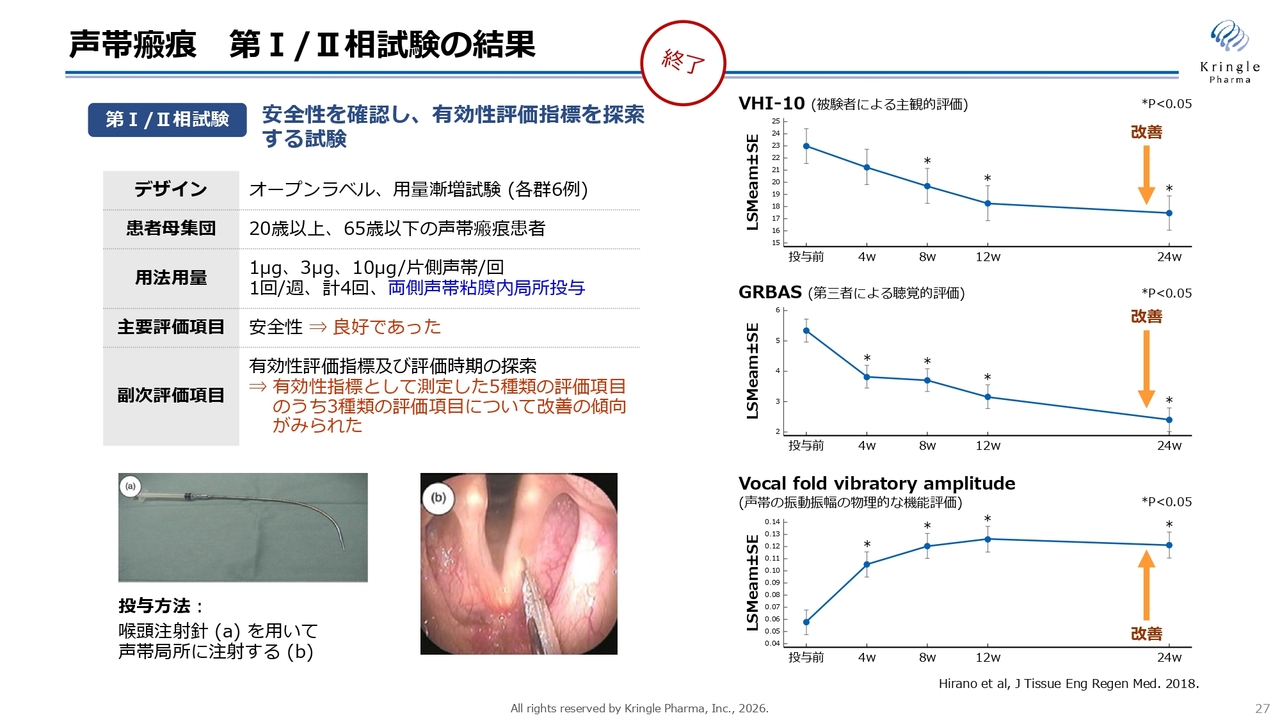
当社は平野先生と協力して、国内で第Ⅰ/Ⅱ相試験を実施しました。オープンラベルの用量を3段階に分けた試験を終了しており、安全性を確認するとともに、スライド右側に示した3つの指標で有効性が確認されています。
患者さま自身の声に関する評価は「VHI-10(被験者の主観的な評価)」で示されており、最上段に記載しています。中段の「GRBAS (第三者による聴覚的評価)」は、患者さまの声を第三者である専門家が聞き、その声を評価する方法を指します。そして、一番下が「Vocal fold vibratory amplitude(声帯の振動振幅の物理的な機能評価)」です。
これら3つの異なる指標でそれぞれ改善傾向が示されています。本試験はオープンラベルで実施されているためプラセボは含まれていませんが、非常に有望な結果が得られています。
ちなみに、スライド左下の写真は声帯の写真です。左側の長い喉頭注射針を使用し、この声帯に直接HGFタンパク質を投与します。
声帯瘢痕 第Ⅲ相試験(医薬品開発の最終段階)

現在は、最後の試験である第Ⅲ相試験を実施しています。第Ⅲ相試験は、多施設共同のプラセボ対照二重盲検比較試験として行っています。スライド下の矢印に記載のとおり、2022年末から組入れを開始し、この1月にようやく組入れを完了することができました。目標症例数は62症例でしたが、11月に到達し、最終的には65症例まで組入れて終了しました。
この試験は1年間継続します。6ヶ月の二重盲検期があり、その後6ヶ月の継続投与期があります。それぞれ週1回の投与を4回繰り返し、6ヶ月間観察を行います。最後の患者さまが1年間の治験を終了するのは来年1月で、これが最終症例の経過観察終了となります。
その後、データを固定、キーオープンし、データ解析を進める流れになります。トップラインデータの開示時期は2027年前半が具体的に見えてきています。
この試験は国内の8施設で実施していますが、主要評価項目は前ページのスライド右上に記載している「VHI-10」です。これは、患者さま自身が自分の声の出方を評価するスコアの改善率を、実薬群とプラセボ群で比較することを主要評価項目としています。
2026年9月期第1四半期 経営成績の概況
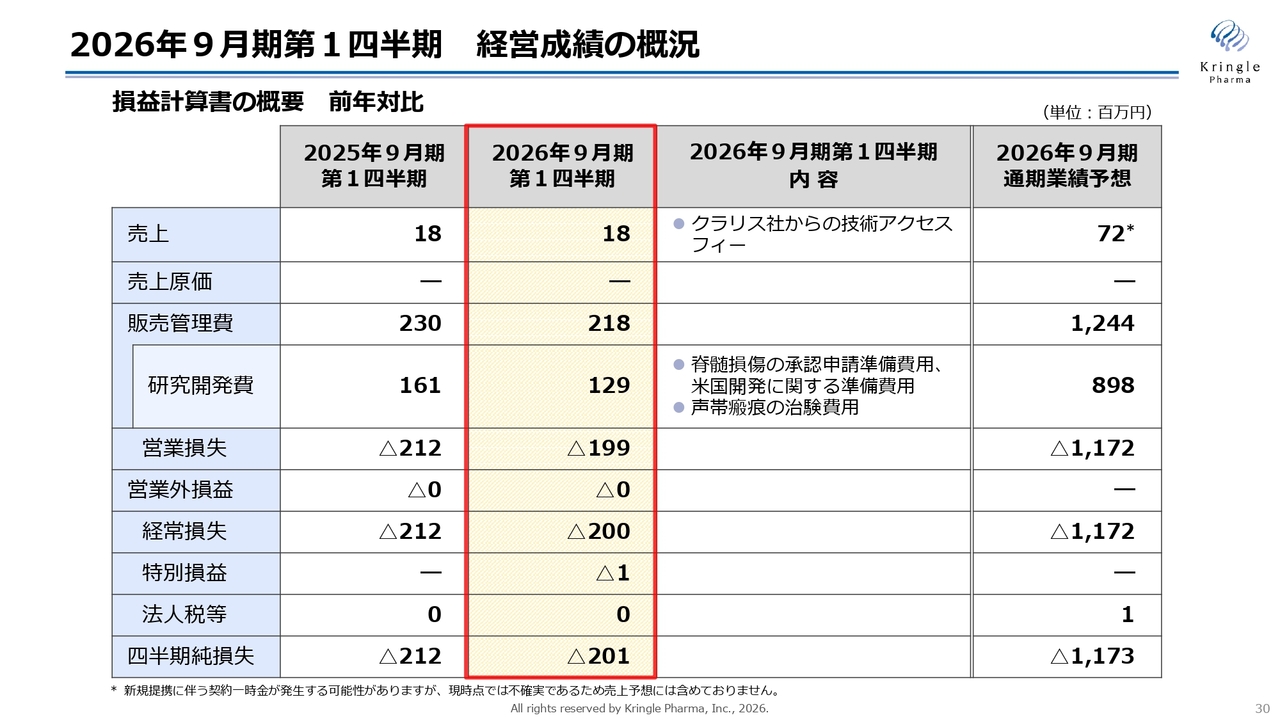
最後に、2026年9月期第1四半期の決算概況についてご説明します。スライドには、損益計算書の概要を前年比でお示ししています。当第1四半期では、クラリス社からの技術アクセスフィーとして1,800万円を計上しました。販売管理費は2億1,800万円で、そのうち研究開発費は1億2,900万円となっています。内訳は、脊髄損傷の承認申請準備費用、米国開発に関する準備費用、声帯瘢痕の第Ⅲ相試験の費用です。
営業損失は1億9,900万円、経常損失は2億円となりました。今回、特別損益としてマイナス100万円を計上しています。これは米国の子会社における開発費用の支出に伴い、子会社株式の評価損を計上したものです。最終的に、四半期純損失は2億100万円となりました。
2026年9月期第1四半期 財政状態の概況
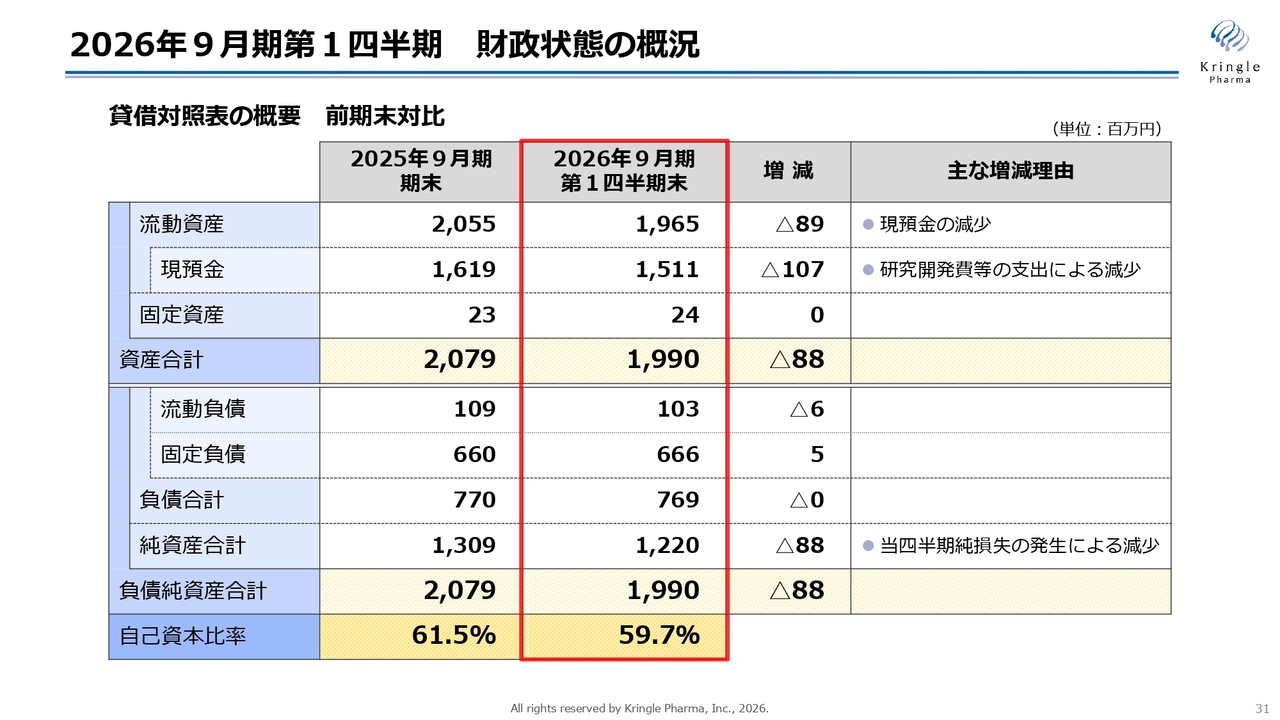
貸借対照表の概要を前期末比でご説明します。第1四半期末の流動資産は19億6,500万円で、そのうち現預金が15億1,100万円、資産合計は19億9,000万円となっています。
一方、負債については、流動負債が1億300万円、固定負債が6億6,600万円で、純資産合計は12億2,000万円です。負債純資産合計は19億9,000万円となっています。自己資本比率は前期末から若干減少しましたが、59.7パーセントです。
クリングルファーマのビジョン
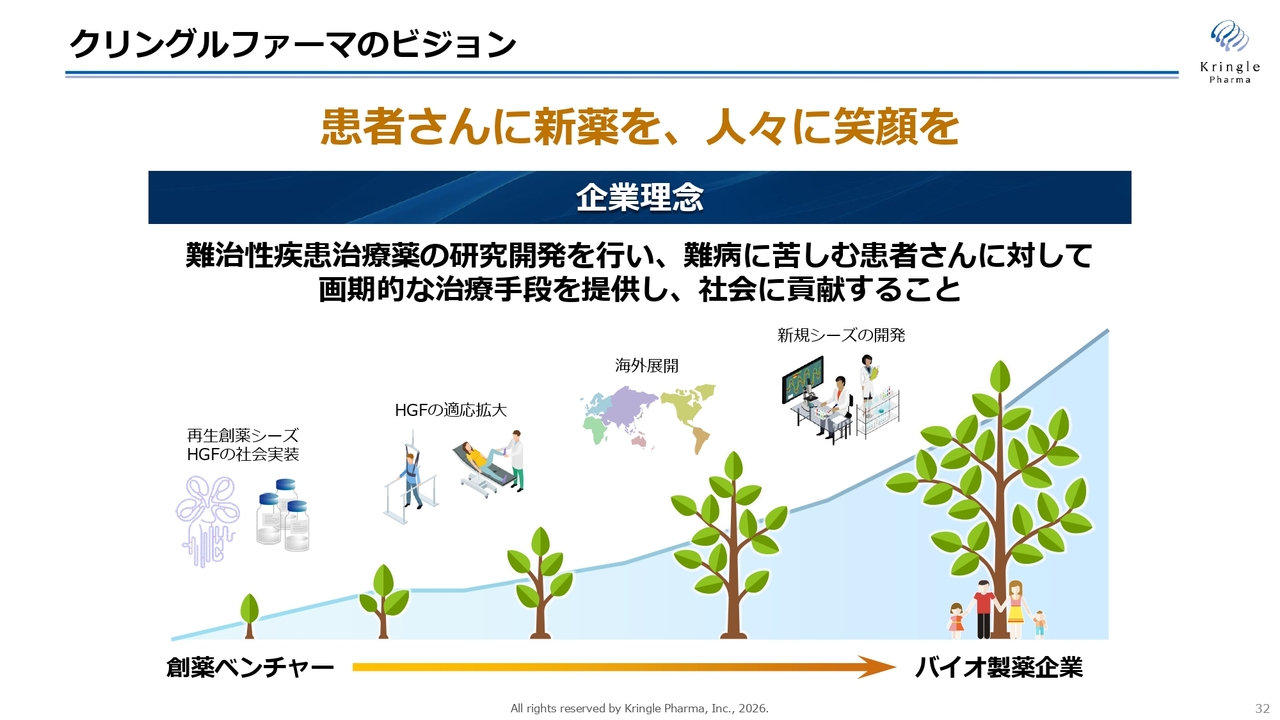
いつもお示ししている最後のスライドになります。当社は創薬ベンチャーからバイオ製薬企業へと成長する未来を目指しています。
まず、再生創薬シーズとして、HGFについて脊髄損傷急性期および声帯瘢痕の国内での開発を着実に進め、これを上市します。その後、海外へ積極的にアプローチし、できるだけ早く展開を進めるとともに適応拡大を図り、HGFの価値を最大化していきます。将来的には、HGFに次ぐ新しいシーズを導入し、開発を進めていきます。
単なる創薬ベンチャーではなく、一気通貫できるバイオ製薬企業へと成長することを目標に、今後も開発を進めていきます。みなさま、引き続きご支援とご鞭撻を賜りますよう、よろしくお願いします。本日はご清聴ありがとうございました。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4884
|
381.0
(11:30)
|
-11.0
(-2.80%)
|
関連銘柄の最新ニュース
-
クリングル(4884) 「2026年9月期 第1四半期決算説明」の... 今日 11:40
-
クリングル(4884) 個人投資家向けIRセミナー【バイオ IR ... 02/12 11:00
-
新興市場銘柄ダイジェスト:リンクバルが急騰、ブロードエンタープライ... 02/10 15:54
-
決算プラス・インパクト銘柄 【東証スタンダード・グロース】引け後 ... 02/10 15:53
-
クリングル---続伸、26年9月期第1四半期の業績を発表 02/10 13:00
新着ニュース
新着ニュース一覧-
-
今日 12:15
-
今日 12:15
-
今日 12:13

